109國中會考自然科第32題
題目
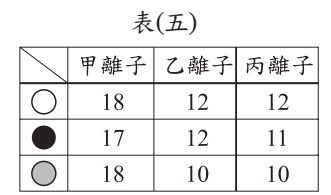
表(五)列出三種離子的中子數、電子數和質子數,且分別以不同的球表示中子、電子和質子(未依照此順序排列)。已知這三種離子中有兩個為正離子,一個為負離子,則表中負離子的電子數應為多少?
(A) 10 (B) 12 (C) 17 (D) 18
答案
D
解析
本題主要是問原子形成離子的觀念。
一個原子失去電子時,原子核外的電子數目就會少於核內質子數目,為正離子。
一個原子得到電子時,原子核外的電子數目就會多於核內質子數目,為負離子。
所以原子形成正離子或負離子是以電子數目與質子數目來比較,
電子數目與質子數目一定不相同才會形成離子。
表(五)兩個為正離子,一個為負離子,
甲離子:電子數18 >質子數17,負離子
乙離子:電子數10 <質子數12,正離子
丙離子:電子數10 <質子數11,正離子
所以甲離子 (負離子) 的電子數為18
(D)選項,負離子的電子數為18,是正確數字,所以答案選D。
解題技巧
本題中的關鍵詞「兩個為正離子,一個為負離子」,先從表(五)中判斷出質子與電子,電子數目與質子數目一定不相同才會形成離子,再找出甲離子的電子數18 >質子數17為負離子,所以甲離子(負離子) 的電子數為18。
知識節點
電中性
原理
一、電中性:一個質子所帶的電量與一個電子所帶的電量一樣多,但兩者電性相反,當電子數和質子數相等,則原子保持電中性。
說明:原子是電中性,質子數必等於電子數。
質子數 = 電子數
二、正電與負電
1.質子位於原子核內,數目不會改變,一般物質帶電,都是電子移轉結果。
2.正電:一個原子失去電子時,原子核外的電子數目就會少於核內質子數目,此時原子就帶正電。
3.負電:一個原子得到電子時,則原子核外的電子數目就會多於核內質子數目,此時原子就帶負電。
三、判斷原子種類的依據
1.原子序:原子核中所含的質子數,稱為此元素的原子序,為判斷原子種類的主要依據。
2.同一種元素的原子,其質子數必相同,不同一種元素的原子,其質子數必不相同。
沒有留言:
張貼留言